Om Atomet
Kære Malte
Vi har haft et projekt om atomer i vores klasse, og har med henblik på at vores lærers usagn:
"En teori holder stik, indtil andet er bevist", illustreret et atom. I og med at ingen før har afbilledet et atom burde vores illustration holde stik Så vi har valgt at lave en grundig undersøgelse af det enkelte atom, og prøvet at finde frem til hvordan det enkelte atom må se ud.
Vi ønsker af den grund et udsagn fra Niels Bohr Instituttet om, hvorvidt vores illustration kan være et relevant bud på hvordan atomet ser ud, og hvis ikke, hvorfor det da så ikke er noget relevant bud.
Ud fra vores teori, går atomer sammen og danner stoffer, derfor har vi givet den en masse arme til at holde fast på andre atomer. Rundt om atomet, har vi lavet et kraftfelt, som trækker andre atomer til sig, og hjælper fangarmene til at holde fast på de andre atomer. Og sidst men ikke mindst, har vi givet den øjne. Ikke for at sige at et atom har øjne, men for at fortælle at det er en levende organisme.

I er landet hos Spørg om fysik. Den model i viser ligner en model der anvendes i kemien en del.
Først lidt forudsætninger, atom nr. 1 i det såkaldt periodiske system er Brint (Hydrogen), som har en proton i kernen og en elektron udenom, nr. 2 er Helium, som er en såkaldt ædelgas med 2 protoner (og 2 neutroner) i kernen og to elektroner udenom. Når man går til stof nr. 3, som er metallet Litium, er der tre protoner i kernen (og 3 neutroner) og 3 elektroner udenom osv.
Vi vil ikke interessere os så meget for kernerne i denne sammenhæng, det der giver stofferne deres kemiske egenskaber er elektronerne. Vi kan tænke os elektronerne ligger i cirkelbaner udenom atomkernen.
I den inderste cirkelbane er der kun plads til 2 elektroner, det kan man vise i en teori, der hedder kvanteteorien. I den næste bane er der plads til 8 elektroner, den er altså fuld ved stof nr. 10, som er ædelgassen Neon (kendt fra reklameskilte, rødt lysende). Sådan går det stort set videre alle de 92 stoffer, der findes i naturen (der er nogen små afvigelser, men de betyder ikke noget for forklaringen her).
De kemiske egenskaber afhænger stort set kun af, hvor mange elektroner der er yderst, i Uran er der 92 elektroner, men udefra ser man kun de 6 yderste, de skærmer for resten, og giver Uran dets kemiske egenskaber.
Det viser sig, at der er minimal energi, når man har ædelgas forhold så alle atomer (bortset fra 1 Brint som helst vil have 2) er tilbøjelige til at søge at få 8 elektroner udenom sig, hvis det er muligt (naturen går efter den laveste energi, kan noget trille ned af en bakke eller flade ned sker det). Det kan opnås ved at danne kemiske forbindelser. Man kan skrive antallet af elektroner med prikker:
Brint skrives så H·, Litium som Li· fordi de 2 inderste elektroner i den inderste bane afskærmes af elektronen i den yderste bane, det næste stof Beryllium kan skrives ·Be·, Ilt (Oxygen) som ·Ọ· (1 prik under, 1 til siden og 2 prikker på hver af de to andre sider, ilt er stof nr. 8 og har derfor 6 elektroner yderst), nedenunder ses hvordan Ilt får 8 elektroner uden om sig og tilsvarende vand hvor ilt får 8 elektroner og Brint 2 hver.
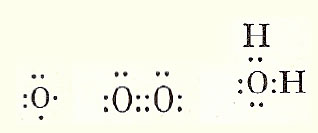
Man kan vel godt sige at jeres model minder om denne model hvor elektronerne (når der ikke er 8) er de arme der rækkes ud, for at danne en kemisk forbindelse. Stofferne er så ivrige efter at danne forbindelser, at f.eks. et Iltatom ikke kan være alene mere end brøkdele af sekunder, så finder det et eller andet at forbinde sig til. Nu har vi så også forklaringen på, at man kalder nogen stoffer for ædle luftarter, det er stoffer med 8 elektroner yderst. De er ikke tilbøjelige til at forbinde sig mede noget som helst, i jeres billede, de har ingen arme.
Med venlig hilsen
Malte Olsen
