Carbondioxid (kultveilte) i sodavand (og øl)
Hej Spørg om Fysik
Hvis man ryster en sodavand så brusen går af, vil der så stadig findes kulsyre/kuldioxid i sodavanden, når den ikke længere har brus - eller forsvinder den helt som "ingrediens"?
På forhånd tak for svar.
Med venlig hilsen
S P

Når man bryggede øl i gamle dage, var der ofte carbondioxid (kulsyre) i, fordi øllet ofte ikke var gæret helt færdigt. Og den gæring der sker efter flasken er blevet lukket, den udvikler kulsyre, som opløses i vandet, og det giver overtryk. Det samme gælder champagne, hvor der er kulsyretryk på, fordi man tilstræber en eftergæring.
Sodavand i dag laves i mange tilfælde også med carbondioxidtryk på, men der er også varianter uden. Kulsyren giver en lidt skarp sur smag, som normalt overdøves af et passende smags- eller sødemiddel. Carbondioxidtrykket i flasken kommer fordi, at man tilsætter kulsyre i flasken lige før den lukkes. Mange vil kende processen, fordi man kan lave sodavand selv med hjælp af et apparat, hvor man sætter tryk på vandet fra en carbondioxidflaske, lige før der tilsættes smagsmiddel og farve, og det er lige før flasken lukkes. På bryggerier kommer carbondioxiden ofte fra gæringen af øl, hvor den kan opsamles.
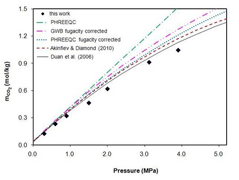
Punkterne viser opløst mængde carbondioxid i vand ved forskellige tryk
På grafen ses mængden af kulsyre i vandet som funktion af carbondioxidtrykket. Man ser, at des højere tryk, des mere kulsyre. Trykket i kommercielle flasker varierer, men er ofte omkring 850 kPa, hvilket opløser ca. 10 g carbondioxid pr. liter vand. Når flasken åbnes begynder kulsyren at omdannes til carbondioxid og dampe af. Det ses ved bobledannelse i flasken, men det er en langsom proces igennem næsten ligevægte, så øl eller sodavand bliver først ”dovent” i løbet af en del timer. Tiden afhænger af flere ting, såsom overflade, evt. delvis lukning, temperatur, rystning af flasken mm.
På den anden kurve ses kulsyreindholdet, som funktion af temperaturen. Vil man have mest muligt kulsyre ud som carbondioxid skal man opvarme.
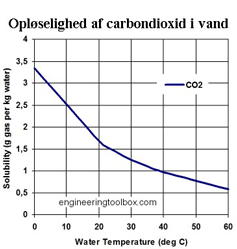
Grafen viser opløst mængde carbondioxid i afhængighed af temperaturen
Sodavandsligningen
Nede i vandet opstår der en ligevægt, den nedenstående reaktionsligning kaldes sodavandsligningen:
CO2 + 2 H2O <=> [H2CO3] + H2O <=> H3O+ + HCO3- + H2O <=> 2 H3O+ + CO3—
Den beskriver, at carbondioxid og vand reagerer og danner teoretisk et overgangsprodukt, som man kunne kalde kulsyre (akkurat som saltsyre og svovlsyre). Det er i firkantet klamme, fordi det straks reagerer videre til de to ioner HCO-3 og CO-2 og syreionen H3O+.
De dobbelte pile betyder, at det er ligevægtsprocesser, som kan forskydes frem og tilbage, hvis man laver om på koncentrationen af en af tingene. Kommer man f.eks. et opløseligt karbonat, f.eks. Natriumkarbonat (E 500) i væsken, vil der ske en forskydning til venstre. Det samme gælder, hvis kulsyretrykket på overfladen fjernes. Så forskydes processen til venstre, og gassen carbondioxid bobler op.
 Ser man nu igen på den første kurve, ser man, at ved carbondioxidtrykket 0 kPa, er der stadig kulsyre i vandet. På temperaturkurven (kurve 2) ses, at der er ca. 3,3 g pr. liter ved 0 °C (1 liter carbondioxid vejer i øvrigt ca. 2 g i gasform ved 0 °C og 105 kPa).
Ser man nu igen på den første kurve, ser man, at ved carbondioxidtrykket 0 kPa, er der stadig kulsyre i vandet. På temperaturkurven (kurve 2) ses, at der er ca. 3,3 g pr. liter ved 0 °C (1 liter carbondioxid vejer i øvrigt ca. 2 g i gasform ved 0 °C og 105 kPa).
Med venlig hilsen
Malte Olsen
