Hvornår begynder udvikling af varme under kompression?
Hej Spørg om Fysik
Gasser og stoffer udvikler som bekendt varme under kompression, men hvornår begynder udviklingen af varme?
Er det først når molekylerne begynder at kollidere, og der bliver trangt med plads? eller sker varmeudviklingen allerede når molekylerne begynder at nærme sig hinanden?
Hvis ja, hvad er det så for en kraft der virker mellem molekylerne (underforstået at molekylerne fordeler sig jævnt i rummet og ikke kolliderer).
Med venlig hilsen
N J

Hvis man f.eks. har et stempel i en cylinder med en gas indeni i ligevægt, og presser stemplet ned, så komprimeres gassen indeni, og gassen bliver varmere. Det kender alle som har pumpet en cykel med en håndpumpe.
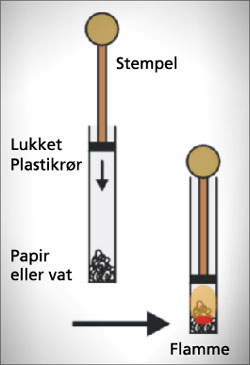
Demonstrering af sammenhæng mellem tryk og
temperatur, der viser grundprincippet for en diesel-
motor. Læs mere nederst på
siden om opfindelsen af dieselmotoren.
Det der sker, det er, at man udfører et arbejde, som er kraften, der skal til for at flytte stemplet de gange den vej stemplet flyttes, og det arbejde udføres så på gassen (vi går ud fra, at der ikke er gnidning imellem stempel og cylinder, som kræver noget arbejde). Gasmolekylernes middelhastighed, v, stiger.
Dette sker fordi molekylerne rammer det indadgående stempel og kastes tilbage med større middelhastighed da stemplet er på vej imod dem, men også fordi molekylerne i høj grad støder sammen, og derved hurtigt fordeler den øgede middelhastighed til alle molekyler i cylinderen.
Middelhastigheden begynder at stige straks, når nogle molekyler får større fart. Middelhastigheden hænger sammen med den absolutte temperatur, T, (målt i kelvin fra det absolutte nulpunkt -273,16 ˚C), ved:
½m*v2 = 3R*T/(2N0) → v2 = 3R*T/(N0*m)
Hvor m er molekylmassen (for atmosfærisk luft i middel 2,9*10-2 kg/mol), R gaskonstanten (R = 8,31 J/(mol*K), og N0 Avogadros tal, som er antal molekyler i et mol (N0 = 6,022*1023 molekyler pr. mol). Heraf fås at m = 2,9 * 10-2/6,022*1023 = 4,8*10-26 kg for atmosfærisk luft. Udregner man farten af molekylerne ved normal temperatur og tryk, ligger atmosfærisk luftmolekylers fart i middel omkring v =500 m/s og tilsvarende hydrogen (Brint) omkring v = 2000 m/s.

Hvis man f.eks. har et stempel i en cylinder med
en gas indeni i ligevægt, og presser stemplet ned,
så komprimeres gassen indeni, og gassen bliver
varmere.
Princippet i en cykelpumpe
For f.eks. en cykelpumpe, som er 0,5 m lang, tager molekylerne i middel 1/100 sek. for at komme fra den ene ende til den anden, hvis de ikke støder ind i andre molekyler (det gør de næsten helt sikkert), så stort set alle er påvirkede på mindre end 1/100 sek.
I en pumpe som er ½ m lang og ca. 3 cm i diameter er der omkring 1022 molekyler. Stemplet rammes af ca. 1024 molekyler pr. sek. ved 1 atmosfærer og stuetemperatur.
For alle praktiske formål er det en momentan proces, så længe apparatet har en størrelse, som kan håndteres ved håndkraft. Det er klart, at laves der enorme apparater med meget store dimensioner, optræder der en reel forsinkelse af processen, men i samme øjeblik, at de enkelte molekyler får større fart på grund af processen, så bliver der en større middelhastighed. Så når man begynder at udføre arbejde på en gas, så stiger middelhastigheden, og dermed temperaturen straks. Det bør rimeligvis nævnes, at trækker man stemplet ud, sker der tilsvarende - en afkøling af gassen i cylinderen.

B & W Diesel, måske verdens største. Bemærk manden på forsiden.
Dieselmotorens kompressionsforhold
Et praktisk eksempel hvor kompressionsprocessen anvendes. En dieselmotor opfundet af Rudolf Christian Karl Diesel (D, 1858 i Paris - 1913).

Rudolf Christian Karl Diesel
En bil har kompressionsforhold imellem 15:1 og 22:1 som resulterer i et tryk på f.eks. omkring 4 MPa (40 bar). Gassen i cylinderen opvarmes til over 550 ˚C, hvorefter dieselolien indsprøjtes og antændes. Da omdrejningstallene f.eks. kan være fra 3000 til 6000 omdr./sek. (50 til 100 stempel-slag pr. sek. med tænding for hvert andet slag) taler vi om en kompressionsproces, som tager 1/50 sek. - og hvor interessen er, at al gas, dieselblandingen i cylinderen, har en temperatur, så den antændes.
Med venlig hilsen
Malte Olsen
